In questo articolo dell'immunologo Paolo Bellavite, è mostrato attraverso vari e recenti studi internazionali quanto questa ipotesi su alcuni effetti avversi a seguito della vaccinazione, debbano essere presi (almeno) in considerazione.
Renina-angiotensina, COVID-19 e vaccinazioni: un "caveat".
Sistema renina-angiotensina, SARS-CoV-2 e ipotesi su alcuni effetti avversi a seguito della vaccinazione
SFERO - 26 febbraio 2021
Riassunto
La malattia da coronavirus 2019 (COVID-19) colpisce i polmoni ma anche il sistema cardiovascolare, soprattutto perché la proteina spike della sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2) utilizza l'enzima di conversione dell'angiotensina II (ACE2), esistente su la membrana di molte specie cellulari, come recettore. Questa connessione ha conseguenze sul sistema renina-angiotensina, sulla pressione arteriosa e sulla coagulazione. Lo squilibrio del controllo della pressione sanguigna e del sistema chinine si verifica nella malattia naturale, ma si riflette anche in parte in alcune possibili conseguenze negative a seguito della vaccinazione anti-covid. La conoscenza di questi meccanismi potrebbe aiutare ad identificare i soggetti più a rischio di complicanze e ad effettuare correttamente la valutazione di causalità degli eventi avversi.
Introduzione
Un aspetto cruciale del COVID-19 riguarda l’impatto del virus sul sistema renina-angiotensina, deputato al controllo della circolazione, della pressione arteriosa e degli equilibri idro elettrolitici, ma anche di alcuni meccanismi infiammatori. È proprio questo uno dei principali sistemi sconvolti dall’arrivo del SARS-CoV-2 e quindi responsabile delle sue conseguenze.
Poiché il virus agisce mediante le “spine” (spike) e il vaccino stesso produce le spikes (più o meno simili a quelle “selvagge”), c’è da spettarsi che anch’esso causi modifiche su questo sistema con possibili conseguenze patologiche. Qui presento un'ipotesi, che potrebbe interessare i medici che hanno in cura i pazienti, i ricercatori e coloro che si occupano della “vaccinovigilanza”. Ho sottoposto questa teoria anche ad una rivista scientifica e, mentre sono in attesa di ricevere risposta, l’ho pubblicata in manoscritto come “Preprint” [1]. Ho già avuto positivi riscontri da alcuni colleghi ed è per questo che ritengo utile far conoscere le idee anche ad altri tramite questa nuova piattaforma, rendendomi disponibile a ricevere commenti anche critici. Naturalmente, i “non addetti ai lavori” devono sapere che, limitatamente a quanto riferito sui vaccini, si tratta di ipotesi fondate teoricamente ma non ancora confermate sperimentalmente.
Il ruolo di ACE2
È ben noto che il virus SARS-CoV-2 utilizza ACE2 (angiotensin-converting enzyme 2) come recettore di ingresso cellulare e ciò ha notevoli conseguenze nel corso della malattia COVID-19 [2]. Infatti, ACE2 normalmente distrugge la angiotensina II, un peptide di 8 amminoacidi che ha azione ipertensiva e provoca la ritenzione idrica, e la trasforma in “angiotensina 1-7”, che ha un effetto ipotensivo. ACE2 è legato alla membrana di molti tipi cellulari (detta “mACE2”), ma ne esiste anche una forma solubile, libera nel plasma, detta “sACE2”. Inoltre, va considerato che ACE2 non si trova solo sulle cellule della parete dei vasi sanguigni, a anche in molti altri tipi cellulari, come le mucose (es. bocca, intestino), cuore, cervello, rene, fegato, piastrine del sangue.
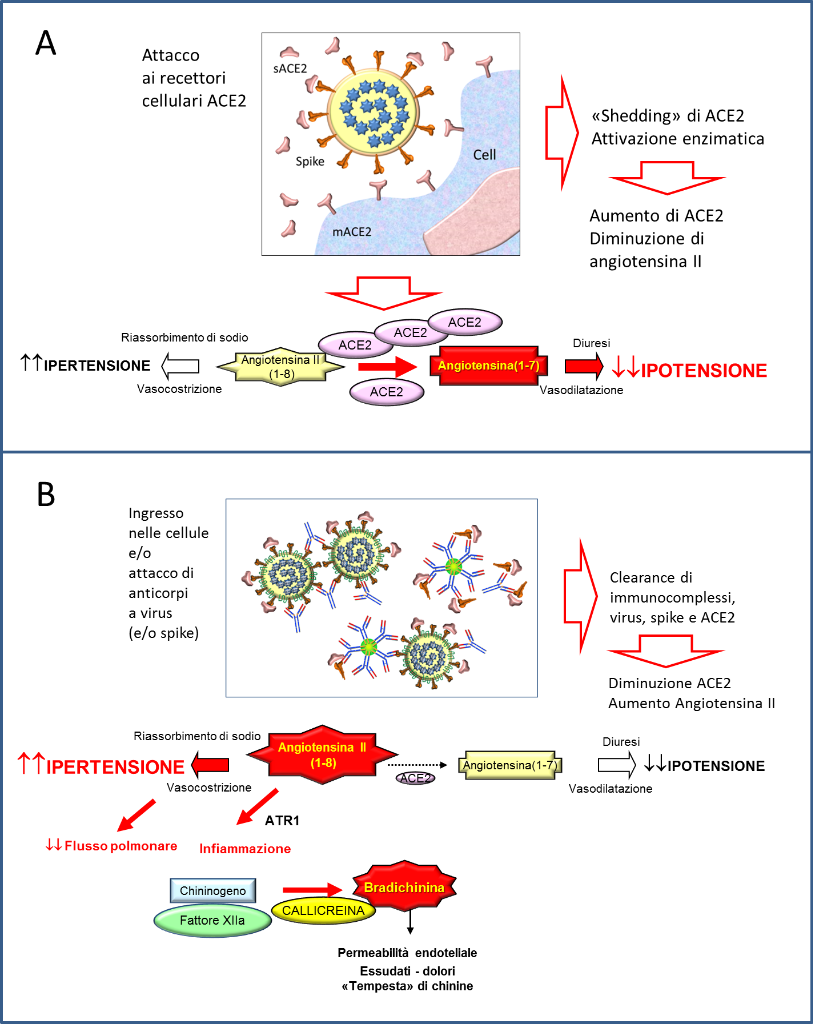
Nel momento in cui i virus si attaccano alle cellule, una certa quantità di molecole ACE2 si staccano dalle membrane per azione di enzimi proteolitici e passano nel plasma, e in questo caso possono avere l’effetto di diminuire la angiotensina II portando all’ipotensione [3] (Figura 1A). Al quadro fisiopatologico descritto si aggiunge il fatto che la proteina spike trimerica di SARS-CoV-2 aumenta di 3-10 volte l'attività proteolitica ACE2 [2].
Figura 1. Modello concettuale del disequilibrio del sistema renina-angiotensina indotto da SARS-CoV-2. A: nel caso in cui l’infezione aumenti l’attività di ACE2; B: nel caso in cui il virus o il sistema immunitario portino ad una diminuzione della ACE2.
Il calo di ACE2
Il problema maggiore emerge nel momento in cui i virus, con legate molecole di sACE2 o attaccati alle ACE2 di membrana, entrano nelle cellule uscendo dalla circolazione, oppure quando sono captati dagli anticorpi (formatisi dopo alcuni giorni dall’inizio della malattia) e dal sistema dei fagociti, che pure li portano via dalla circolazione. A quel punto, l’attività ACE2 diminuisce e, di conseguenza, aumenta l’angiotensina II, provocando un nuovo squilibrio endocrino e vascolare (Figura B). È stato sostenuto che l'ingresso di cellule SARS-CoV-2 determini una sottoregolazione dell'ACE2 legato alla membrana, e questo meccanismo può provocare lesioni polmonari e vasocostrizione perché viene a mancare la conversione di angiotensina II in angiotensina 1-7 [3, 6].
Inoltre, si generano squilibri nel sistema delle chinine fino al cosiddetto “kinine storm” (tempesta di chinine) [7, 8]. Fisiologicamente, ACE2 svolge un ruolo nella regolazione del sistema delle chinine, eliminando la bradichinina che è normalmente responsabile di fenomeni infiammatori ed essudati. E’ stato dimostrato che gli elementi chiave dei sistemi di bradichinina, angiotensina e coagulazione sono co-espressi con ACE2 nelle cellule alveolari del polmone e ciò potrebbe spiegare come i cambiamenti in ACE2 promossi dall'ingresso di cellule SARS-CoV-2 determinano lo sviluppo delle forme cliniche più gravi di COVID-19 [9, 10]. Di fatto, anche l’infiammazione mediata da bradichinina genera complicazioni respiratorie pericolose per la vita in COVID-19[11].
I pazienti con COVID-19 hanno anche un aumento del volume piastrinico medio e dell'iperattività piastrinica, correlato a una diminuzione della conta piastrinica complessiva. Questo fenomeno è stato attribuito all'effetto della proteina spike che si lega all'ACE2 presente sulla loro membrana e aumenta l'aggregazione piastrinica e la secrezione di granuli densi indotta da vari agonisti [5]. Va ricordato che i granuli densi contengono serotonina e che un eccesso di essa può causare vari sintomi (sindrome serotoninergica) tra cui alterazioni dello stato mentale, agitazione psicomotoria, tremori, contrazioni muscolari involontarie, nausea, vomito, diarrea.
Infine, va considerato che l’insorgenza di immunità dopo qualche giorno dall’infezione potrebbe accelerare la “clearance” dei virus e se questi hanno legato sACE2, ciò potrebbe causare una rapida diminuzione della attività ACE2 circolante. Lo stesso meccanismo potrebbe forse complicare l’effetto dei vaccini, perché di essi è proprio la proteina spike l’elemento determinante [3]. Inoltre, dosi minime di proteina spike purificata inducono la produzione di molti tipi di citochine nel sangue intero dei pazienti con COVID-19 ma anche la produzione di alcune citochine come RANTES (regolate all'attivazione, cellule T normali espresse e secrete), PDGF, fattore di crescita derivato dalle piastrine) e IL-9 nel sangue di persone non COVID [12].
Le spike del vaccino
Alla luce di queste evidenze, è possibile ipotizzare che possano insorgere disturbi della pressione del sangue, delle chinine e dell’aggregazione piastrinica anche per l'azione delle proteine spike prodotte a seguito della vaccinazione coi prodotti biotecnologici attualmente in uso (a mRNA e vettori adenovirali). Di conseguenza, uno squilibrio della pressione sanguigna potrebbe insorgere inaspettatamente in due direzioni opposte: a) ipotensione, nel caso in cui le nuove proteine spike attivino la funzione enzimatica di ACE2 nel plasma o nella membrana cellulare, oppure b) rapido aumento della pressione sanguigna e infiammazione sistemica, nel caso in cui le proteine spike si leghino a sACE2 e vengano poi eliminate da anticorpi di nuova formazione. Un modello concettuale di queste dinamiche è presentato nella figura 2. Questo è un aspetto finora poco considerato dalla letteratura. Purtroppo si sa poco di quante spike sono prodotte dalle cellule in cui è entrato il mRNA, quali cellule sono interessate e per quanto tempo.
 Figura 2. Schema concettuale dei possibili squilibri del sistema renina-angiotensina causati dal virus SARS-CoV-2 o dalle spike. La linea ondulata indica in maniera simbolica e ipotetica le oscillazioni dell’attività ACE2 plasmatica a seguito delle trasformazioni indicate nel testo.
Figura 2. Schema concettuale dei possibili squilibri del sistema renina-angiotensina causati dal virus SARS-CoV-2 o dalle spike. La linea ondulata indica in maniera simbolica e ipotetica le oscillazioni dell’attività ACE2 plasmatica a seguito delle trasformazioni indicate nel testo.Secondo le regole AIFA, i farmaci richiedono prove di farmacocinetica prima dell’approvazione, cosa da cui sono esentati i vaccini.
È importante tenere a mente queste possibilità nella cura clinica dei pazienti COVID-19 ma anche quando si valuta il nesso causale di qualsiasi evento avverso dopo la vaccinazione che coinvolge il sistema cardiovascolare, come arresto cardiaco, ictus, emorragia e shock. Un improvviso aumento della pressione potrebbe anche essere fatale nelle persone con aneurismi cerebrali.
Quando si effettua una valutazione di causalità di eventi avversi gravi, le linee guida dell'OMS chiedono di considerare tutte le altre possibili cause che potrebbero aver portato all'evento [13]. Le linee guida spiegano quindi che una storia medica dettagliata, esami clinici e indagini, inclusi test di laboratorio sul paziente, possono aiutare a identificare altre condizioni come altre malattie e anomalie congenite che potrebbero aver causato l'evento. Questa procedura sembrerebbe logica e valida solo se l '"altra condizione" fosse indipendente da una possibile INTERAZIONE con l’effetto del vaccino e col suo meccanismo d’azione. Ecco perché la plausibilità biologica di una relazione causale (o concausale) è così importante [14, 15], soprattutto quando sono coinvolti vari fattori patogeni.
Il fatto che vaccini-farmaci a mRNA o vettori virali realizzati in modo da produrre proteine spike possano avere un'influenza disregolatoria sul sistema renina-angiotensina significa che, in caso di persone affette da malattie di natura cardiovascolare, un'interazione tra il prodotto iniettato e la condizione sottostante è più plausibile rispetto al caso di altri vaccini. Sebbene i benefici della vaccinazione in persone che potrebbero essere gravemente colpite da COVID-19 sono indiscutibili, ignorare il problema delle possibili interazioni del vaccino con ACE2 potrebbe portare a una sottovalutazione sistematica del rischio rappresentato da questi nuovi prodotti biotecnologici, in particolare nelle persone portatrici di cardiopatie o vasculopatie.
Inoltre, essere coscienti del rischio può orientare meglio a svolgere adeguate indagini diagnostiche, come in particolare la valutazione della pressione del sangue, numero e funzionalità delle piastrine, fattori della coagulazione. Nel testo citato sono descritte anche possibili analisi più approfondite [1]. Naturalmente, l’identificazione tempestiva di uno squilibrio nei meccanismi descritti potrebbe forse aiutare il clinico a intervenire con adatti farmaci, come ad esempio gli antagonisti del recettore dell’angiotensina II (sartani) o altri regolatori delle piastrine o dell’infiammazione. Ma se non ci si pensa, si può procedere a vaccinare senza neppure considerare i rischi.
Voci bibliografiche citate
[1] Bellavite P. Renin-Angiotensin System, SARS-CoV-2 and Hypotheses about Some Adverse Effects Following Vaccination. SSRN- Preprints. 2021 Feb 12;abstract_id=3781903.https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3781903
[2] Lu J, Sun PD. High affinity binding of SARS-CoV-2 spike protein enhances ACE2 carboxypeptidase activity. J Biol Chem. 2020 Dec 25;295(52):18579-88.
[3] Rahman MM, Hasan M, Ahmed A. Potential detrimental role of soluble ACE2 in severe COVID-19 comorbid patients. Rev Med Virol. 2021 Jan10.
[4] Bernard I, Limonta D, Mahal LK, et al. Endothelium Infection and Dysregulation by SARS-CoV-2: Evidence and Caveats in COVID-19. Viruses. 2020 Dec 26;13(1).
[5] Zhang S, Liu Y, Wang X, et al. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J Hematol Oncol. 2020 Sep 4;13(1):120.
[6] Costa LB, Perez LG, Palmeira VA, et al. Insights on SARS-CoV-2 Molecular Interactions With the Renin-Angiotensin System. Front Cell Dev Biol. 2020;8:559841.
[7] McCarthy CG, Wilczynski S, Wenceslau CF, et al. A new storm on the horizon in COVID-19: Bradykinin-induced vascular complications. Vascul Pharmacol. 2020 Dec 21;106826.
[8] Garvin MR, Alvarez C, Miller JI, et al. A mechanistic model and therapeutic interventions for COVID-19 involving a RAS-mediated bradykinin storm. Elife. 2020 Jul 7;9.
[9] Oz M, Lorke DE. Multifunctional angiotensin converting enzyme 2, the SARS-CoV-2 entry receptor, and critical appraisal of its role in acute lung injury. Biomed Pharmacother. 2021 Jan 5;136:111193.
[10] Sidarta-Oliveira D, Jara CP, Ferruzzi AJ, et al. SARS-CoV-2 receptor is co-expressed with elements of the kinin-kallikrein, renin-angiotensin and coagulation systems in alveolar cells. Sci Rep.
2020 Nov 11;10(1):19522.
[11] Roche JA, Roche R. A hypothesized role for dysregulated bradykinin signaling in COVID-19 respiratory complications. FASEB J. 2020 Jun;34(6):7265-9.
[12] Petrone L, Petruccioli E, Vanini V, et al. A whole blood test to measure SARS-CoV-2-specific response in COVID-19 patients. Clin Microbiol Infect. 2020 Oct 10.
[13] WHO. Causality assessment of an adverse event following immunization (AEFI): user manual for the revised WHO classification (Second edition) . 2nd Edition edn. Geneva: World Health Organization; 2018.
[14] Puliyel J, Naik P. Revised World Health Organization (WHO)'s causality assessment of adverse events following immunization-acritique. F1000Res. 2018;7:243.https://f1000research.com/articles/7-243
[15] Bellavite P. Causality assessment of adverse events following immunization: the problem of multifactorial pathology. F1000Res. 2020;9:170. https://f1000research.com/articles/9-170
Seguici sul canale telegram:


“La proteina spike codificata dal vaccino si lega all'enzima di conversione dell'angiotensina 2 (ACE2), un enzima che contiene molecole di zinco. Il legame della proteina spike all'ACE2 ha il potenziale per rilasciare la molecola di zinco, uno ione che fa sì che TDP-43 assuma la sua trasformazione prionica patologica ".
RispondiElimina